Bis jetzt haben sich die Methoden, die wir zur Messung von gelöstem Wasserstoff diskutiert haben, nur auf Messungen mit verschiedenen Arten von elektrischen Geräten konzentriert. Wir sollten jedoch eine andere einfache und bewährte Methode zur Messung gelösten Wasserstoffgases mit einem Redox-Titrationsreagens untersuchen.
Was ist Titration?
Wenn Chemiker mit einer Lösung konfrontiert werden, die eine unbekannte Menge einer gelösten Verbindung oder eines gelösten Gases enthält, wird oft eine Titration durchgeführt, um das Niveau der unbekannten Konzentration zu bestimmen.
Titration wird üblicherweise verwendet, um solche Eigenschaften wie pH, Chlor oder gelösten Sauerstoff in Wasser zu messen.
Bei einer Titration werden kleine, genaue Mengen (Tropfen) einer Lösung bekannter Konzentration (Titriermittel) langsam zu einer genauen Menge einer Testprobe (etwa 6 ml) zugegeben, die eine unbekannte Konzentration des gelösten Stoffes enthält, bis ein Hinweis vorliegt (wie eine Farbänderung), dass die Titration abgeschlossen ist.
Dies wird als „Titrationsendpunkt“ bezeichnet, und basierend auf der Menge an Titriermittel, die hinzugefügt wurde, um den Endpunkt zu erreichen, kann die unbekannte Konzentration des gelösten Stoffes in der Lösung bestimmt werden.
Über das Redox-Reagens, welches üblicherweise zum Nachweis von gelöstem Wasserstoff verwendet wird
Bei der Wahl des Redox-Reagens als Indikator für den Einsatz mit einer bestimmten gelösten Verbindung muss sorgfältig vorgegangen werden um sicherzustellen, dass es mit dem fraglichen gelösten Stoff reagiert.
Denn in unserem Fall, da wir gelöstes Wasserstoffgas messen wollen, wird eine Verbindung benötigt von der wir wissen, dass sie unter den erwarteten Bedingungen von Temperatur, pH usw. reagieren und uns sichtbare Anzeichen sowohl für das Vorhandensein von H2 als auch für das Erreichen des Titrationsendpunkts liefern wird.
Eine gute Wahl für die Messung von gelöstem Wasserstoff ist Methylenblau (MB), ein dunkelgrünes Pulver, das sich wie Ethanol beim Lösen in einem Lösungsmittel tiefblau färbt.
MB wird in der Medizin als biologischer Gewebefarbstoff und Mittel zur Behandlung verschiedener Erkrankungen eingesetzt.
Als Oxidationsmittel ist es bekannt, dass in einem Trägerlösungsmittel gelöstes MB (in Gegenwart eines Platinkatalysators) mit molekularem Wasserstoff reagiert.
Das Endprodukt der Reaktion ist die klare Form von MB, nämlich Leukomethylenblau (LeukoMB), wie folgt:

Wie Equation 8 zeigt, ist Methylenblau (MB) im Ausgangszustand eine blaue Flüssigkeit und reagiert mit H2 zu Leukomethylenblau (LeukoMB), der reduzierten Form von MB. Da diese Form von MB „klar“ ist, wenn sie in Wasser gelöst ist, erfüllt sie die Anforderung, dass das Titriermittel einen „sichtbaren Hinweis“ auf das Vorhandensein unserer gelösten Substanz H2 liefert.
Die beiden Strukturdiagramme in Figure 15 zeigen sowohl die oxidierten als auch die reduzierten Formen des MB-Moleküls:
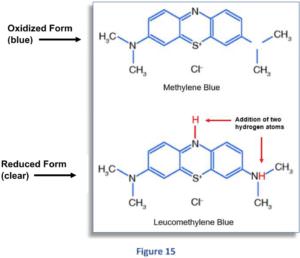
Wie Sie sehen können, besteht der einzige Unterschied zwischen den beiden Molekülen in der Addition der zwei Wasserstoffatome (in rot) im unteren Diagramm, die während der Reaktion an das MB-Molekül gebunden werden.
Diese Atome stammen aus dem Wasserstoffmolekül, das zu Beginn aus zwei miteinander verbundenen Wasserstoffatomen (H2) besteht.
Während der Reaktion spaltet sich H2 (unter Einwirkung des Platinkatalysators) in zwei Wasserstoffatome (H), die dann an zwei verschiedenen Stellen an das MB-Molekül andocken.
Wird das Methylenblau-Reagens der Probe beigefügt, die gelöstes H2-Gas enthält, werden die H2-Moleküle daher „verbraucht“, wenn sie mit MB reagieren. Wenn mehr Tropfen hinzugefügt werden, wird das gesamte H2 in der Probe schließlich erschöpft sein. Zu diesem Zeitpunkt wird jeder hinzugefügte Tropfen Titriermittel blau gefärbt bleiben, was darauf hinweist, dass der Titrationsendpunkt erreicht worden ist. Es ist auch erwähnenswert, dass es eine Eins-zu-Eins-Entsprechung in der Reaktion zwischen den H2- und MB-Molekülen gibt und jedes MB-Molekül ein H2-Molekül (zwei Wasserstoffatome) verbraucht.
Wenn man die Molekulargewichte jedes Moleküls kennt, wird es daher einfach, ein Reagens zu konstruieren, das eine bekannte Menge an gelöstem H2 pro Tropfen verbraucht (1 Tropfen entspricht typischerweise 0,1 mg/l gelöstem H2).
Dies ermöglicht es uns, die Gesamtzahl der erforderlichen Tropfen zu addieren damit das gesamte H2 in der Testprobe verbraucht wird (Titrationsendpunkt) um die Konzentration an gelöstem H2 zu bestimmen. Wie bei vielen anderen Redoxreaktionen hat die Reaktion zwischen H2 und MB eine geringe pH-Sensitivität bei den Extremwerten der pH-Skala (empfohlener Testprobenbereich ist 4 bis 10 pH). Da dieses Verfahren jedoch nicht auf der Messung des Redoxpotentials beruht, wie bei einem ORP-basierten Gerät, ist die pH-sensible Reaktion des Reagens innerhalb des wahrscheinlichen pH-Bereichs der meisten, wenn nicht aller Wasserstoff-trinkwasser geringfügig. Ein beliebtes Methylenblau Titrationsmittel wie H2 blue® bietet dem Anwender eine einfache, verlässliche und kostengünstige Methode zur genauen Bestimmung von gelöstem Wasserstoffgas.
Auszug aus dem Buch von Randy Sharpe: “Der Zusammenhang zwischen gelöstem H2, pH-Wert und Redoxpotential”




