Die nach dem deutschen Chemiker Walther Nernst benannte Nernst-Gleichung ist eine Gleichung, die das Standardreduktionspotential einer elektrochemischen Reaktion auf die Konzentration, den Druck und die Temperatur einer chemischen Spezies bezieht, die unter Nichtgleichgewichtsbedingungen reduziert und oxidiert wird. Es ist die wichtigste Gleichung auf dem Gebiet der Elektrochemie.
Equation 5 zeigt die allgemeine Form der Nernst-Gleichung. In diesem Artikel werden wir die Nernst-Gleichung verwenden, um die Rollen von gelöstem Wasserstoffgas und pH zu analysieren 5, um vorherzusagen, wie stark diese jeweils die ORP-Messung beeinflussen. Bevor wir die Nernst-Gleichung verwenden können, um damit ORP-Werte für Wasser mit gelöstem Wasserstoffgas vorherzusagen, müssen wir deren allgemeine Form geringfügig modifizieren.
Da das Standardzellenpotential für Wasserstoff E0 = 0 ist (siehe Tabelle 1), können wir diesen Ausdruck eliminieren. Wir werden auch die Begriffe „[red]“ und „[ox]“ durch die reduzierten und oxidierten Formen von Wasserstoff H2 bzw. H+ ersetzen.
Die endgültige Form der Nernst-Gleichung, die wir verwenden werden, ist in Equation 6 dargestellt:


Da das von uns gemessene Wasserstoffwasser unter Standardbedingungen nicht existiert, erlaubt uns die Nernst-Gleichung, alle von uns gewählten Werte für Konzentration, Druck und Temperatur zu ersetzen und das Redoxpotential unter nicht standardisierten Bedingungen vorherzusagen.
Unter Verwendung der Nernst-Gleichung können wir mit verschiedenen Werten für H2 und H+ experimentieren und ihre vorhergesagte Wirkung auf das ORP analysieren. Im Folgenden finden Sie Definitionen für die Begriffe und Werte, die in der Nernst-Gleichung verwendet werden:
- Emv, Nernst-Potential in Millivolt (ORP);
- E0, Standardzellenpotential, 0,00 V;
- R, universelle Gaskonstante, 8,314 JK-1mol-1
- T, Temperatur, 298,150 K (25 ° C / 77 ° F);
- z, # Anzahl der in der Reaktion übertragenen Elektronen, 2;
- F, Faraday-Konstante, 96485,33 Cmol-1 (Elektronenladung pro Mol)
- [H2], Wasserstoffgaskonzentration (im Partialdruck, pH2);
- [H+], Wasserstoffionenkonzentration (abgeleitet vom pH-Wert).
Durch die Nernst-Gleichung vorhergesagte ORP-Werte werden unter idealen Bedingungen berechnet. Während die tatsächlichen Feldmessungen von ORP in Abhängigkeit von einer Reihe von Faktoren variieren, bleiben die Beziehungen zwischen pH, H2 und ORP gleich.
Um die Berechnung des vorhergesagten Redox-Potentials unter verschiedenen Szenarien von Temperatur/H2 /pH zu automatisieren, wurde die Nernst-Gleichung in einen Rechner (mit MS-Excel / VBA) programmiert.
Die berechneten Ergebnisse für jedes Szenario wurden dann verwendet, um die H2, pH und Redox-Datentabelle (mit nach x und y geordneten Paaren) zu erstellen, die zum Zeichnen der verschiedenen in diesem Artikel verwendeten Graphen erforderlich ist.
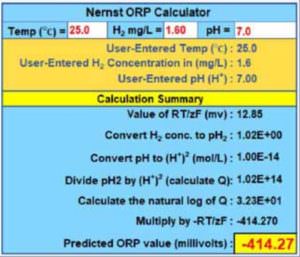
Figure 4 zeigt die Benutzeroberfläche des Nernst-Rechners, der nicht nur das vorhergesagte Redoxpotential anzeigt, sondern auch die meisten Zwischenergebnisse:
Obwohl es nicht unser Ziel ist, die Nernst-Gleichung im Detail zu diskutieren, wird uns ein genauerer Blick auf Equation 6 eine wichtige Einsicht über die Berechnung des ORPs geben. Figure 5 zeigt die beiden Spezies aus der Nernst-Gleichung, die unser „Redox-Paar von Interesse“ bilden:
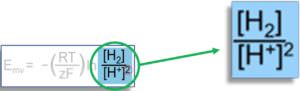
Wie wir bereits besprochen haben, stellen diese beiden Formen von Wasserstoff (oxidierte und reduzierte Formen) die zwei Arten im Wasser dar, deren Konzentrationen zum Redoxpotential des Wassers beitragen. Während Wasser normalerweise mehrere Redoxpaare enthält, deren Redoxpotentiale zusammen den Gesamt-ORP bilden, betrachten wir in unserer Analyse nur das H+/H2 Redoxpaar. Der Ausdruck „[H2]“ steht für die Konzentration von gelöstem Wasserstoffgas (ausgedrückt als Partialdruck, pH2) und der Ausdruck „[H+]“ steht für die Konzentration von Wasserstoffionen (die wir aus dem pH-Wert des Wassers berechnen).
Daher hängt die ORP-Ablesung nicht von der Konzentration des gelösten Wasserstoffgases alleine ab, sondern von den Konzentrationen von sowohl H2 als auch H+.
Wie wir sehen werden, trägt jede dieser Arten zur ORP-Messung bei. Da wir gesehen haben, dass das gelöste H2 für das negative ORP verantwortlich ist, impliziert dies eine Beziehung zwischen den beiden und wirft einige Fragen auf:
- Wie viel gelöstes H2 wird benötigt, um ein negatives ORP zu erzeugen?
- Wie stark reagiert die ORP auf Änderungen der H2-Konzentration?
- Können wir den ORP-Wert verwenden, um den Gehalt an gelöstem H2 zu messen?
- Können wir die ORP-Messwerte von zwei verschiedenen Proben verwenden, um ihre relativen gelösten H2-Konzentrationen zu vergleichen?
Die Nernst-Gleichung wird uns helfen, diese Fragen zu beantworten, da sie uns eine Analyse erlaubt, wie Änderungen von H+ und H2 die ORP-Messung beeinflussen.
Auszug aus dem Buch von Randy Sharpe: “Der Zusammenhang zwischen gelöstem H2, pH-Wert und Redoxpotential”




